Перша мРНК-вакцина проти СНІДу виявилася ефективною в експериментах на мишах і мавпах. Вакцина з генетичним кодом двох вірусних білків викликає сильну відповідь антитіл одразу проти кількох варіантів вірусу імунодефіциту. У макак багаторазова вакцина знижує ризик заразитися на 79%. Це породжує надію, що ефективна проти коронавірусу технологія мРНК-вакцин зможе допомогти й у боротьбі з ВІЛ.

Вірус імунодефіциту на імунній клітині людини. Поки що не існує ефективної вакцини проти збудника СНІДу. Зображення: NIAID
Не пройшло й року, як учені розробили вакцину проти коронавірусу, а над вакциною проти вірусу імунодефіциту науковці працюють уже 40 років — досі здебільшого марно. Всі спроби озброїти імунну систему живою протеїновою або генетичною вакциною проти ВІЛу закінчувалися розчаруванням. Досі найефективніший варіант у клінічних дослідженнях досягнув показника 30% захисту — і навіть його не вдалося відтворити.
Проблема полягає в тому, що білок в оболонці вірусу Env дуже варіативний і легко змінюється. Крім того, важливі ознаки оболонки вірусного протеїну прикривають цукрові вставки. У вірусі імунодефіциту ці глюкани створюють “камуфляж”, що вкриває практично всю оболонку вірусу.
“Тож для вакцини дуже складно виробити антитіла нейтралізації, дуже складно і лише в незначної частки інфікованих природним способом такі тіла виникають”, — пояснили Пен Джан (Peng Zhang) з Американського національного інституту алергії та інфекційних захворювань (NIAID) та його колеги.
Проте технологія мРНК надає шанс подолати цю проблему. Адже з нею у вакцині можна об’єднати генетичний код конкретних вірусних протеїнів та їхні частки, налаштувавши її на оптимальну дію. “Наша експериментальна вакцина поєднує одразу кілька ознак, які компенсують вади попередніх кандидатів на ВІЛ-вакцину”, — пояснив провідний автор дослідження Ентоні Фочі (Anthony Fauci) з NIAID.
Зокрема до складу нової ВІЛ-вакцини входить РНК з інструкціями для побудови Env — вірусного білка оболонки. У варіанті, розробленому для першої дози вакцини, цей оболонковий білок був позбавлений цукрових додатків, завдяки чому його краще розпізнавала імунна система.
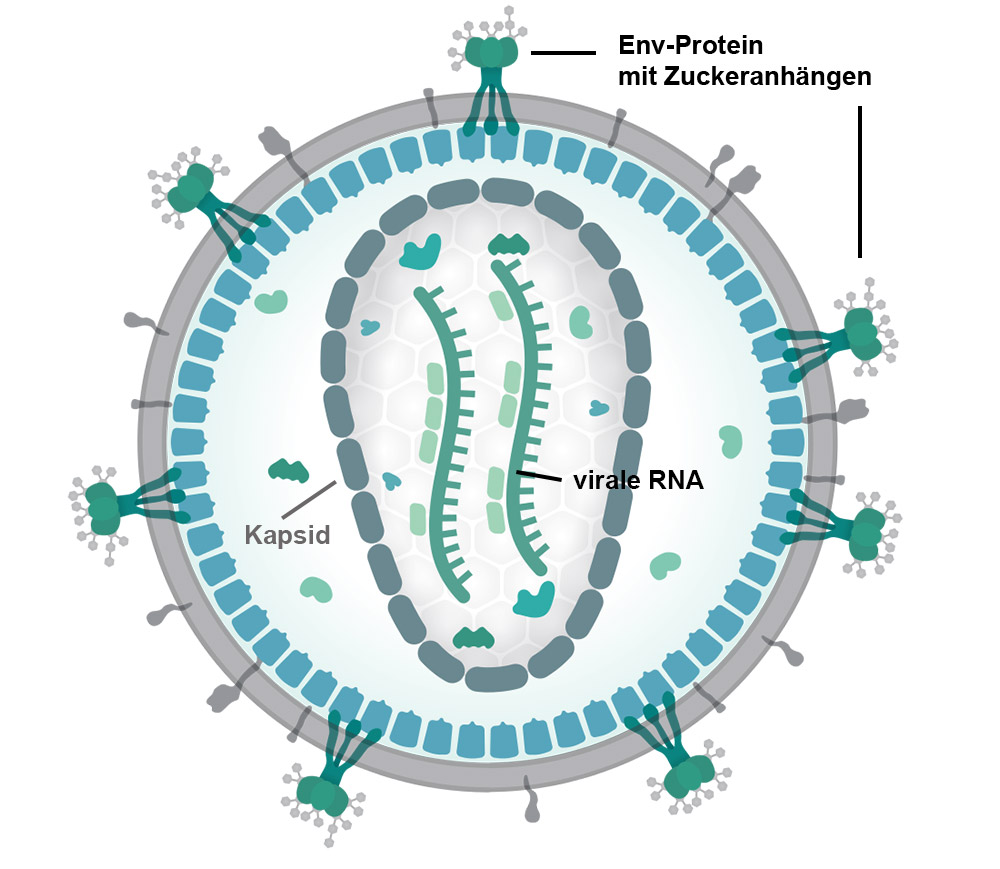
Будова вірусу імунодефіциту. Зображення: Thomas Splettstoesser (www.scistyle.com)/ CC-by-sa 4.0.
Натомість вакцина для дози підсилення (бустерної) містила коди цілісного протеїну для кількох мутацій ВІЛ-1. “Це повинно було підсилити відповідь B-клітин на загальні мішені антитіл”, — пояснила команда.
Важливо й те, що мРНК-вакцина містить генетичний код для другого вірусного білка (Gag).
Поєднання цих двох білків вистачило, щоб тіло стимулювало утворення вірусоподібних частинок — маленьких утворень, чия поверхня подібна до природного вірусу імунодефіциту. В тестах на мишах це призвело до того, що всі вакциновані тварини виробляли антитіла для нейтралізації вірусу, повідомили Джан та його колеги.
Наскільки добре ця мРНК-вакцина захищає проти інфекції імунодефіциту, науковці перевірили на 14 макаках. Одна половина мавп з перервою два-три тижні отримала дози різних варіантів вакцин, інша залишилася невакцинованою. Команда з’ясувала, що тварини добре переносили вакцину, в них помітили тільки короткочасну втрату апетиту.
Результат: уже після першої бустерної дози титр антитіл у вакцинованих приматів суттєво зріс, хоч і поступово падав знову. Після третьої вакцини антитіла залишалися стабільно на високому рівні, повідомили Джан та його колеги.
Також клітинна імунна відповідь зреагувала на вакцину: через пів року проти ВІЛ діяли як Т-клітини-вбивці, так і Т-клітини-помічники, а коли через понад рік вводили ще одну бустерну дозу, їхня активність знову суттєво посилювалася.
Потім слідували вирішальні тести: через понад рік після першої вакцини всім тваринам раз на тиждень вводили послаблений варіант ВІЛу в пряму кишку. У невакцинованих тварин це призвело до інфікування після третього контакту з вірусом.
“Натомість дві з семи імунізованих тварин навіть після 13 тижня не продемонстрували ознак інфекції”, — повідомили науковці. Решта 5 мавп заразилися значно пізніше, ніж невакциновані — в середньому після восьмого контакту. Тож вакциновані тварини мали на 79% менший ризик заразитися при незахищеному контакті з вірусом.
Крім того, імунний захист діяв проти 12 різних варіантів патогену. “Така мРНК-платформа демонструє перспективний підхід до розробки вакцини проти СНІДу”, — констатують науковці.
Наступним кроком науковці планують оптимізувати вакцину так, щоб треба було вводити меншу кількість бустерних доз. Адже режим вакцинації з понад сімома ін’єкціями для людей не буде прийнятним, а в бідних країнах його буде дуже складно запровадити.
“Тож ми підлаштовуємо протокол вакцинації так, щоб підвищити кількість та якість вірусоподібних частинок, котрі виникають при вакцинації”, — пояснив керівник дослідження Паоло Луссо (Paolo Lusso) з NIAID. Якщо й оптимізована вакцина виявиться ефективною в дослідженнях на тваринах, наступним кроком мають стати клінічні дослідження першої фази. При цьому вакцину вводитимуть здоровим добровольцям, щоб перевірити, як люди її переносять.
Nadja Podbregar
mRNA-Impfstoff bald auch gegen HIV?
Nature Medicine, 2021; doi: 10.1038/s41591-021-01574-5, 10/12/2021, NIH/National Institute of Allergy and Infectious Diseases.
22.12.2021