Здається, науковці знайшли універсальну слабку ланку всіх ракових клітин. Йдеться про протеїн, що відіграє важливу роль у розділенні хромосом при клітинному поділі. Очевидно, клітинам пухлини він допомагає виживати, незважаючи на надлишок хромосом. Тож блокування білка може стати вихідним пунктом нової терапії, повідомили науковці в журналі «Nature».
Веретено поділу відповідає за те, щоб кожна нова клітина отримала правильну кількість хромосом. Але в ракових клітинах воно не працює належно. Зображення: Afunguy/ gemeinfrei.
Рак виникає тоді, коли клітини вироджуються та неконтрольовано розмножуються. Залежно від типу раку та враженої тканини, генетичні ознаки ракових клітин можуть дуже відрізнятися. Деякі виникають у результаті накопичення помилок у ДНК, інші — через несподівані пошкодження хромосом. Ці індивідуальні відмінності ускладнюють ефективну боротьбу з пухлинами.
Але є ознака, яку помітили у понад 90% ракових клітин: їхні клітини містять більш ніж 46 хромосом, а саме така кількість властива нормальним клітинам. Натомість у деяких пухлинах виявили від 60 до 90 хромосом на клітину, а великі ракові клітини можуть містити навіть 8-16 наборів хромосом.
Ця аномалія, яку називають анеуплоїдією, виникає тоді, коли при клітинному поділі веретено поділу неправильно відділяє скопійовані хромосоми одну від одної.
Зараз вчені на чолі з Яелем Коеном-Шаріром (Yael Cohen-Sharir) з Тель-Авівського університету з’ясували, що при такому неправильному поділі важливу роль відіграє білок KIF18A. Його вчені виявили під час експериментів над клітинним поділом із майже тисячею клітинних культур від онкохворих пацієнтів та з вирощеними в лабораторії модельними клітинами. Дослідники проаналізували, які специфічні при цьому гени та молекули активуються в анеуплоїдах.
Результат: один етап клітинного поділу у ракових клітинах відбувається по-іншому. Цей так званий веретеновий блокпост (spindle checkpoint) зазвичай контролює, чи веретено поділу правильно розділяє сестринські хромосоми, і лише тоді запускає клітинний поділ. В анеуплоїдних ракових клітинах цей «пункт пропуску» пошкоджений. Нормальна клітина з неправильною кількістю хромосом швидко відмирає, але ці продовжують жити.

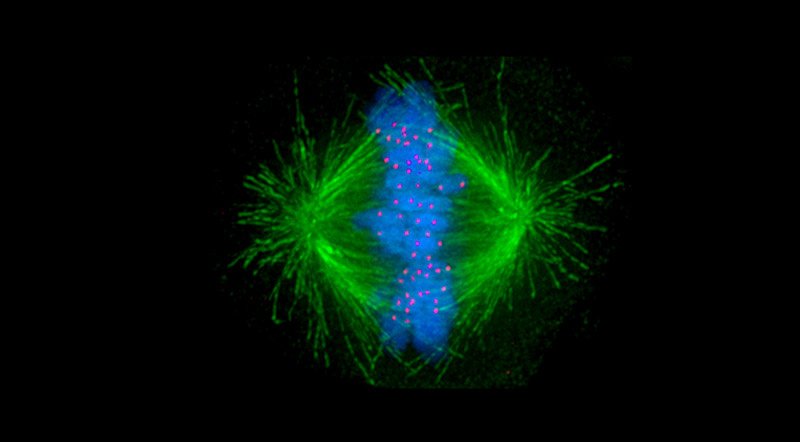
Порівняння поділу нормальної клітини (зверху) та ракової (анеуплоїдної) клітини (знизу). Зображення: Sara Bernhard/ TU Kaiserslautern.
Коен-Шарір та його колеги з’ясували: однією з причин такої аномалії може бути білок KIF18A. Це кінезиновий моторний білок, тобто молекула, що прив’язується до веретена і в такий спосіб залучається до контролю над поділом хромосом. Якщо заблокувати продукування цього протеїну в ракових клітинах, вони втрачають здатність виживати з неправильною кількістю хромосом.
Науковці ще не знають, чим відрізняються функції KIF18A в анеуплоїдних клітинах та у нормальних клітинах, але вони припускають: білок якось помагає клітині, що ділиться, фізично розміщати завелику кількість хромосом. Завдяки візуалізації науковці змогли з’ясувати: веретено поділу в анеуплоїдних клітинах має іншу форму, ніж у нормальних.
На думку науковців, протеїн KIF18A може відкрити новий погляд на процес боротьби з пухлинами: «Наразі немає жодних інгібіторів, які б заблокували KIF18A у людських клітинах. Але коли ми краще зрозуміємо механізм, зможемо розробити хімічну молекулу, що атакуватиме або сам білок KIF18A, або пов’язані з ним процеси», — пояснила співавтор Сюзана Шторхова (Zuzana Storchová) з Кайзерслаутернського технічного університету (Німеччина).
Але зараз ще потрібно з’ясувати, як виявлені процеси протікають у пухлинах в людському організмі. «Наші результати ґрунтуються на спостереженнях за клітинними культурами, тому ми ще не знаємо, якою мірою їх можна екстраполювати на людських пацієнтів, — сказав провідний автор дослідження Урі Вен-Давід (Uri Ben-David) з Тель-Авівського університету. — Але вони відкривають багато перспективних сфер дослідження, які з часом можуть повпливати на процес лікування онкохворих».
Nadja Podbregar
Neue Schwachstelle bei Krebszellen entdeckt
Technische Universität Kaiserslautern Nature, 01/02/2021; doi: 10.1038/s41586-020-03114-6
Зреферувала С.К.
03.02.2021