Німецька BioNTech і американський фармацевтичний гігант Pfizer повідомили про позитивні попередні результати розробки вакцини від коронавірусу. Відносно невеликі дози препарату BNT162b1 (назва перспективної вакцини) виробляють антитіла в тому ж обсязі або більше, що й у виздоровілих пацієнтів.
Компанія Pfizer виклала на сайті medrxiv.org препринт з результатами перших клінічних випробувань своєї вакцини від нового коронавірусу. У відповідь на дворазове введення у пацієнтів зросли – пропорційно до дози вакцини – рівні антитіл до SARS-CoV-2 і з'явилися тимчасова легка недуга (слабіксть) або біль в місці уколу. Переносимість препарату і достатня імунна відповідь свідчать, що вакцина працює, як і проєктувалося.
BNT162b1 належить до РНК-вакцин, тобто до таких, що містять вірусну молекулу, за структурою подібну на ДНК-матричну РНК (мРНК). Ця (її ще інколи називають інформаційною РНК) молекула відповідає за перенесення інформації про первинну структуру білків від ДНК до місць синтезу білків, в даному випадку з неї безпосередньо зчитується вірусний білок. У клітинний геном мРНК не вбудовується.
Вакцина діє таким чином: укладена в ліпідну наночастинку мРНК потрапляє в організм разом з вакциною. Потім ліпідна частка зливається з мембраною клітини-мішені, а її вміст потрапляє в клітину і перетворюється в оцей «шаблон» для синтезу вірусних білків-антигенів. В результаті власні клітини організму почнуть синтезувати вірусні білки – при тому, що вірусна ДНК в клітинний геном вбудовуватися не буде, а її молекули утилізовуватимуться організмом як звичайна мРНК.
До переваг цього типу вакцин належить те, що в якості «вірусу-носія» береться зовсім не SARS-CoV-2, а отже, нема небезпеки, що ослаблений вірус мутує і знову буде викликати хворобу. Крім того, ліпідні частинки з мРНК всередині схожі на вірус, тож самі собою можуть викликати імунну відповідь. Є шанс, що через «подвійну дію» імунітет від РНК-вакцин буде виникати раніше і триматися стійкіше. До того ж коротка мРНК — дуже проста молекула, тому створити її можна відносно швидко і недорого — за допомогою спеціальних синтезаторів.
Ще одна практична перевага – особливо важлива, коли вакцина потрібна швидко і у великих кількостях, – дешевизна виробництва і швидкість розробки: можна взяти за основу перевірену і розроблену один раз мРНК-конструкцію і змінити лише невелику ділянку, щоб отримувати вакцини до абсолютно різних хвороб.
Незважаючи на всі потенційні переваги РНК-вакцин, у них є значний мінус, – спровокована імунна відповідь часто заслабка. Щоб вирішити цю проблему, науковці використовують кількаразову вакцинацію та оптимізують спосіб доставки РНК в клітини.
Отже, BNT162b1 є молекулою РНК, що кодує в якості антигену тримеризований рецепторзв'язувальний домен (RBD) S-білка SARS-CoV2, – найважливішу мішень для нейтралізуючих антитіл. Для посилення імунної відповіді та підвищення ефективності трансляції мРНК (збільшення кількості білка, одержуваного з однієї молекули) in vivo у вакцинній послідовності використано модифікований нуклеозид 1-метилпсевдоуридин. Препарат BNT162b1 призначений для внутрішньом'язового введення. Щоб збільшити шанси вакцини потрапити в клітини, молекули запаковані в ліпідні наночастинки.
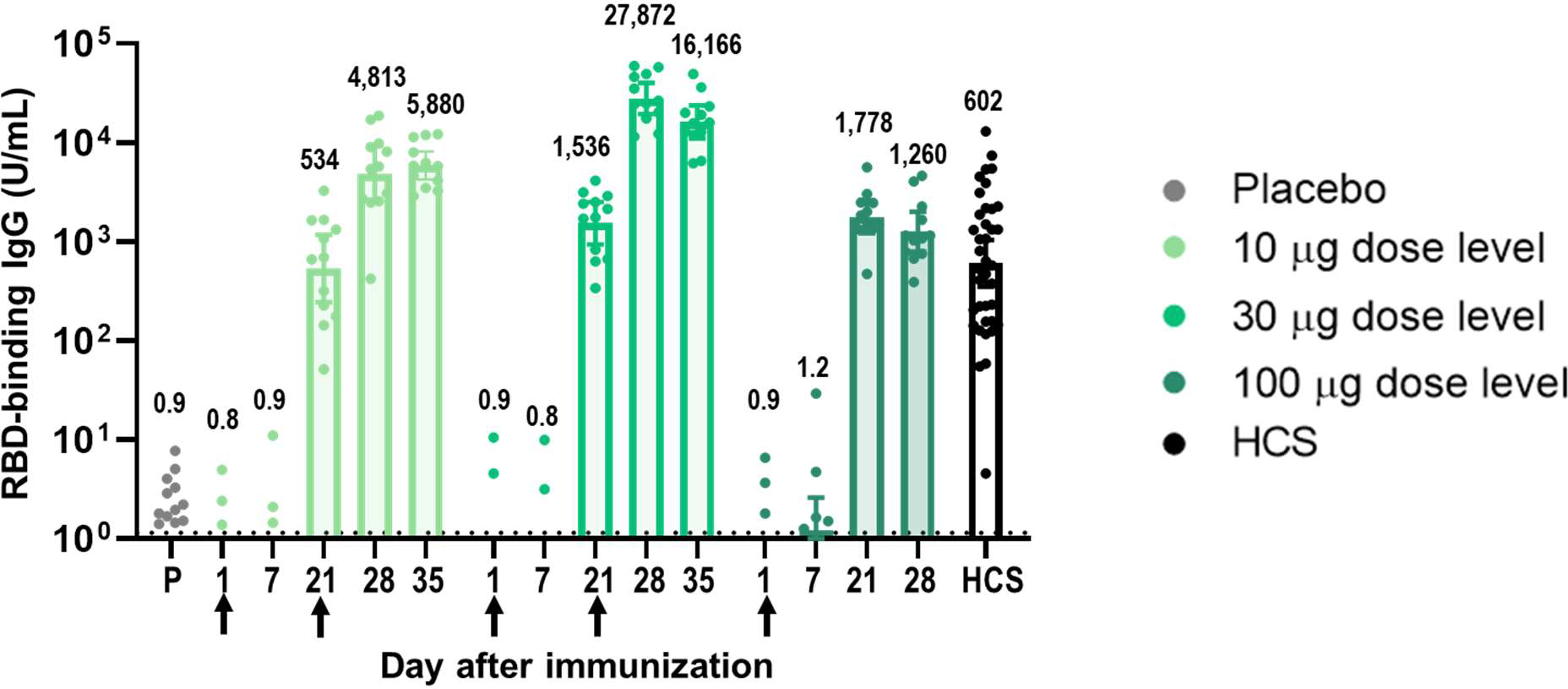
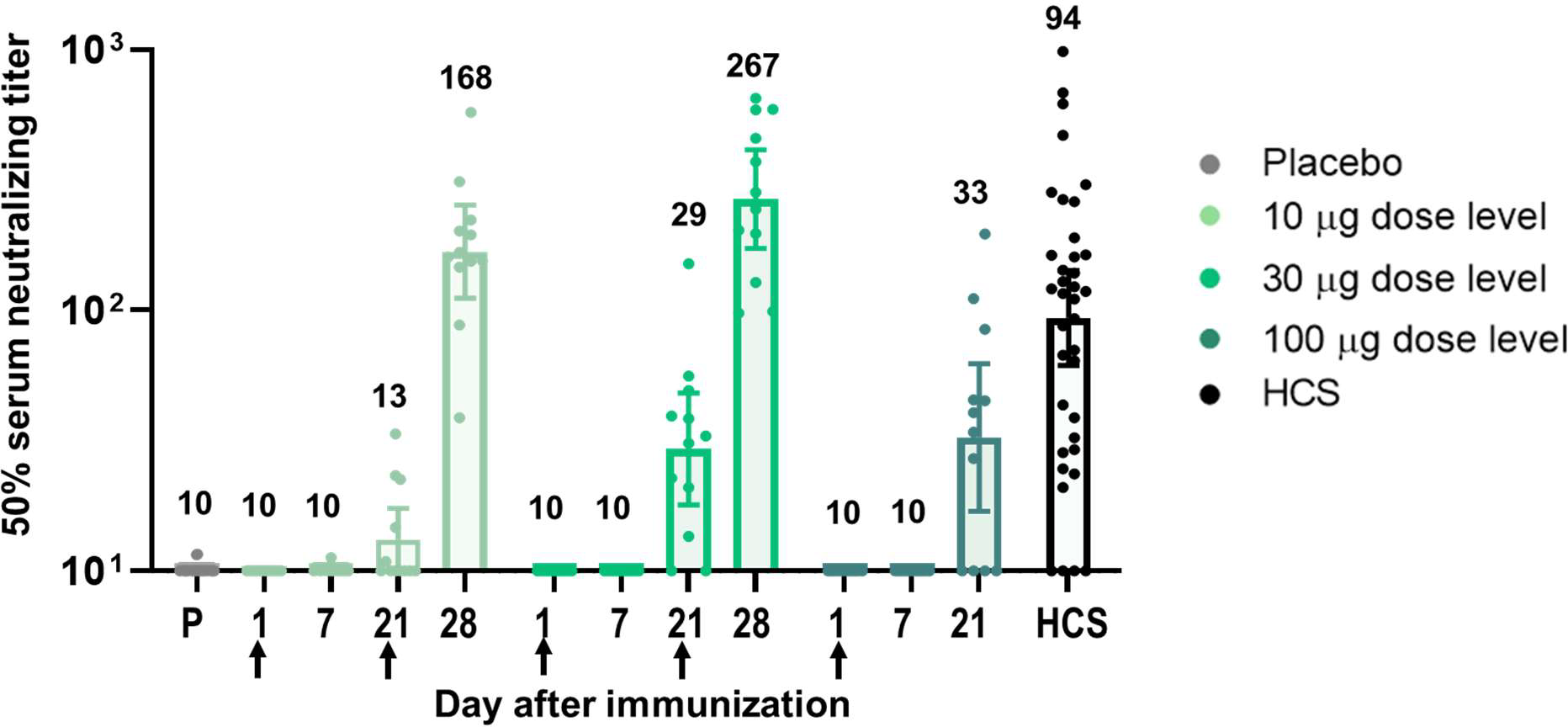
Перші фази клінічних випробувань BNT162b1 провели на 45 дорослих людях віком 18-55 років. Це подвійне сліпе рандомізоване дослідження, в якому 12 пацієнтам вкололи по 10 (дворазово через 21 день), 12 – по 30 (так само дворазово через 21 день) і 12 – 100 (разово) мікрограм вакцини, а решта 9 отримали плацебо. Після вакцинації в учасників перевірили рівень нейтралізуючих антитіл в крові і стежили за проявом побічних ефектів на підставі опитувальників.
Основні скарги пацієнтів протягом тижня після вакцинації були пов'язані з болем в місці уколу, слабкістю і головним болем, і більшість розцінило ці симптоми як легкі або помірні. З тих, що отримали великі дози, по одній особі повідомили про сильний біль, підвищену температуру і безсоння протягом одного з перших днів після вакцинації. У групі, яка прийняла плацебо, побічні ефекти теж спостерігалися, але були виражені значно слабше.
Через 21 день після першого введення вакцини титри антитіл, що впізнають RBD, виявилися одного рівня з титрами у перехворілих людей (534 – 1778 МО/мл), а після повторного введення вакцини – на порядок вищими (5880 –16166 МО/мл). Автори дослідження вважають концентрацію в 10–30 мікрограмів досить безпечною і в той же час імуногенною.
Це була фаза I/II клінічних випробувань, тобто третя-четверта з прийнятих шести:
доклінічна фаза – тестування на нелюдських об'єктах;
нульова фаза – фармакокінетика;
перша фаза – тестування безпечності на здорових 20-100 добровольцях;
друга фаза – тестування ефективності на 100-300 пацієнтах;
третя фаза – тестування ефективності на 300-3000 пацієнтах зі специфічними захворюваннями (в даному випадку, зокрема, особи старшого віку);
четверта фаза – пост-маркетинговий нагляд.
Очікують, що з вакциною BNT162b1, в разі дозволу регуляторів, етап IIb/III почнеться наприкінці липня 2020 року.
Якщо поточні дослідження виявляться успішними, то компанії очікують, що на підприємствах в Німеччині і США до кінця 2020 року буде вироблено до 100 млн доз і більше як 1,2 мільярда доз до кінця 2021 року.
Розробку вакцини підтримує канадська компанія Acuitas, що надає ліпідні наночастинки для виготовлення мРНК-вакцин.
Кілька компаній вже публікували результати перших фаз клінічних випробувань експериментальних вакцин. За даними Лондонської школи гігієни і тропічної медицини, випробування на людях проходять зараз 23 вакцини від COVID-19. Деякі з них перейшли до другої або третьої фази, коли препарат отримують тисячі добровольців, а лікарі оцінюють ефективність, стежать за побічними ефектами і збирають іншу інформацію.
До третьої фази випробувань, зокрема, на початку липня переходить також біотехнологічна компанія Moderna з вакциною mRNA-1273 (теж типу мРНК-вакцин). Заявлено, що Moderna зможе вже випускати до 500 млн доз на рік, а з 2021 року наростити потужності до 1 млрд доз на рік. В США препарат мають виробляти на підприємстві швейцарської компанії Lonza.
04.07.2020