Цьогорічні лауреати Нобелівської премії з хімії – Жак Дюбоше (Jacques Dubochet), Йоахім Франк (Joachim Frank) і Річард Гендерсон (Richard Henderson). Завдяки цим трьом ученим виникла кріоелектронна мікроскопія (або кріо-ЕМ). Цей метод надав змогу спостерігати за біомолекулами в дії та відображати їх з точністю до атома. Завдяки кріо-ЕМ ми отримали унікальні знімки бактерій, що атакують клітини, молекул фотосинтезу в світловій пастці та структури вірусу Зіка.

Жак Дюбоше (зліва), Йоахім Франк (посередині) і Річард Гендерсон (справа). Зображення: Nobel Media/N. Elmehed.
Впродовж тривалого часу біомолекули – зокрема білки, ДНК або РНК – були для біохімії непізнаними. Хоча з допомогою рентгеноструктурного аналізу можна було робити припущення про структуру цих молекул, проте всі отримані знімки демонстрували біомолекулу лише кристалізовану, заморожену. Як ця складна сполука рухається і поєднується з іншими, залишалося великою мірою невідомо. Крім того, багато біомолекул не підлягають кристалізації взагалі, тож вони зовсім не потрапляли в поле зору людини.
Електронний мікроскоп для такого фотографування годився лише умовно. Адже для того, щоб він відбивав випромінювання, розповідаючи про структуру та форму молекули, всі зразки потрібно піддавати затратній підготовці, висушити і, наприклад, нанести на них солі важких металів. Проте ці дії можуть змінити чимало біомолекул, навіть знищити їх.
Британському ученому Річарду Гендеросону цього було недостатньо. В своїй лабораторії у Кембриджі він працював над методом, завдяки якому зміг зробити видимим білок фотосинтезу – бактеріородопсин.
Його ідея: він замінив воду в білковому розчині розчином глюкози, що стабілізувала молекулу в вакуумі електронного мікроскопа. Щоб потужне випромінювання не знищило чутливих білків, Гендерсон та його колеги спробували перевірити, скільки інформації можна отримати з низькими дозами випромінювання. Виявилося, що, поєднавши багато знімків, можна зібрати достатньо даних про молекулярну структуру, і на підставі цього вчені отримати першу придатну для використання картинку.
1975 року Гендерсон і його колеги презентували першу 3D-модель бактеріородопсину, що відображала, як білковий ланцюг молекули сім разів проходив через суміжну клітинну мембрану. Їхні знімки з роздільністю 0,7 нанометра були найкращим зображенням білків, яке будь-коли отримували з допомого електронного мікроскопа. Але роздільна здатність не була точною до атома і цукровий розчин годився не для всіх молекул.
Свій підхід до розв’язання проблеми запропонував і Жак Дюбоше, що працював у Європейській молекулярно-біологічній лабораторії в Гайдельбергу. Він виявив, як молекули в водному розчині у вакуумі електронного мікроскопа можна захистити від висихання.
До нього науковці намагалися просто заморозити проби, проте крижані кристали заважали катодним променям, а з ними – й якісному відображенню.
Дюбоше запропонував таке: він охолодив молекулярні розчини рідким азотом так швидко і радикально, що крижані кристали не утворювалися. Натомість вода скам’яніла до склоподібного твердого тіла, що не заламує випромінювання, тобто дає змогу зробити фото молекули, замкнутої у воді, що перетворилася на скло. 1984 року завдяки цьому методові Дюбоше та його колеги вперше сфотографували вірус у розчині – важливий поступ для медичних досліджень.
Останній крок у втіленні кріоелектронної мікроскопіі в життя зробив Йоахім Франк, що в 70-их роках ХХ століття працював на американське міністерство охорони здоров’я. Він розробив програмне забезпечення, що з багатьох менш чітких зображень електронного мікроскопа створювало 3D-зображення з високою роздільністю. Комп’ютерові це вдавалося в результаті розпізнавання і поєднання повторюваних зразків у молекулярній структурі. Важливо, що завдяки оцінюванню можна було поєднати інформацію про кілька молекул.
Вже 1981 року Франк отримав перші фотографії білків з високою роздільною здатністю. 1991 року науковець поєднав своє програмне забезпечення з методами підготовки Дюбоше та вперше візуалізував 3D-структуру білка.
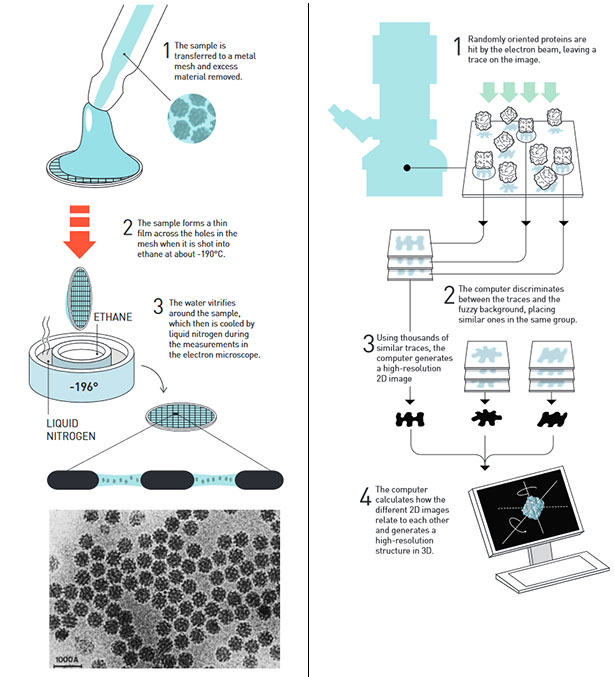
Схематичне зображення методу Дюбоше і Франка. Зображення: The Royal Swedish Academy of Sciences.
У результаті поєднання та покращення всіх трьох методів вдалося сильно вдосконалити кріоелектронну мікроскопію. З 2013 року завдяки їй можна відображати з точністю до атома білки та інші біомолекули. При цьому знімки робляться моментально, фіксуючи молекулу в русі або дії. «Цей метод переніс біохімію у нову еру, – йдеться в поясненні Нобелівського комітету. – Адже зображення – часто ключ до розуміння».
Chemie-Nobelpreis für Cryo-Elektronenmikroskopie
Nobel Foundation, 04/10/2017
Зреферувала Соломія Кривенко
07.10.2017